下列说法中哪一个是正确的?
正确答案:
B
答案解析:
A错误。氢键形成的条件是:氢原子与电负性大、半径小有孤对电子的原子形成强极性共价键后,还能吸引另一电负性较大的原子中的孤对电子而形成氢键。符合该条件的原子只有如O、N、F等原子,故并非所有含氢化合物中的均存在氢键。
B正确。只有极性分子之间才有取向力。当然极性分子之间除存在取向力外,还存在色敦力和诱导力。某些含氢的极性分子中,还可能有氢键,如HF、H O。
O。
C错误。只有电负性大的非金属原子(如VIIA族元素的原子)和电负性小的金属原子如IA族元素的原子)形成化合物时,以离子键结合,其晶体为离子晶体。H与Cl均为非金属元素,它们以共价键结合形成共价型化合物,其晶体为分子晶体。HCI溶于水后,由于水分子的作用HCl才解离成H 和Cl
和Cl 。
。
D错误。根据鲍林规则:含氧酸中不与氢结合的氧原子数(n)越大,酸性越强。所以酸性由强到弱的顺序为:HCIO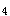 >H
>H SO
SO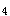 >H
>H SO
SO 。所以正确答案为B。
。所以正确答案为B。
B正确。只有极性分子之间才有取向力。当然极性分子之间除存在取向力外,还存在色敦力和诱导力。某些含氢的极性分子中,还可能有氢键,如HF、H
 O。
O。C错误。只有电负性大的非金属原子(如VIIA族元素的原子)和电负性小的金属原子如IA族元素的原子)形成化合物时,以离子键结合,其晶体为离子晶体。H与Cl均为非金属元素,它们以共价键结合形成共价型化合物,其晶体为分子晶体。HCI溶于水后,由于水分子的作用HCl才解离成H
 和Cl
和Cl 。
。D错误。根据鲍林规则:含氧酸中不与氢结合的氧原子数(n)越大,酸性越强。所以酸性由强到弱的顺序为:HCIO
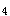 >H
>H SO
SO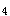 >H
>H SO
SO 。所以正确答案为B。
。所以正确答案为B。普通化学
