某元素最高氧化数为+6,最外层电子数为1,原子半径是同族元素中最小的。下列叙述中哪一个不正确?
正确答案:
C
答案解析:
本题涉及核外电子排布与周期表的问题,根据题意,最高氧化数为+6的元素有VIA族和VIB族元素;而最外层只有一个电子的条件就排除了VIA族元素;最后一个条件是原子半径为同族中最小,可确定该元素是VIB族中的铬。Cr的电子排布式为1s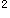 2s
2s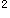 2p
2p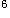 3s
3s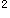 3p
3p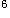 3d
3d 4s
4s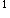 ,所以得出以下结论。
,所以得出以下结论。
A正确。外层电子排布为3d 4s
4s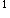 。
。
B正确。因为周期数等于电子层数,等于最高主量子数,即第四周期。它的量后一个电子填充在d亚层上,所以它是副族元素,而副族元素的族数等于[(n-1)d+ns]层上的电子数,对铬来讲为5+1=6,即VIB族元素。
C错误。因为原子失去电子时,首先失去最外层上的电子,继而再失去次外层上的d电子。所以+3价离子的外层电子排布为3s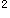 3p
3p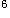 3d
3d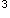 。
。
D正确。Cr的最高氧化物CrO ,其水合物为H
,其水合物为H CrO
CrO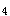 或H
或H Cr
Cr O
O 均为强酸。
均为强酸。
所以答案应为C。
 2s
2s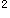 2p
2p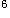 3s
3s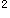 3p
3p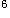 3d
3d 4s
4s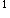 ,所以得出以下结论。
,所以得出以下结论。A正确。外层电子排布为3d
 4s
4s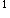 。
。B正确。因为周期数等于电子层数,等于最高主量子数,即第四周期。它的量后一个电子填充在d亚层上,所以它是副族元素,而副族元素的族数等于[(n-1)d+ns]层上的电子数,对铬来讲为5+1=6,即VIB族元素。
C错误。因为原子失去电子时,首先失去最外层上的电子,继而再失去次外层上的d电子。所以+3价离子的外层电子排布为3s
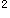 3p
3p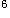 3d
3d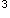 。
。D正确。Cr的最高氧化物CrO
 ,其水合物为H
,其水合物为H CrO
CrO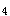 或H
或H Cr
Cr O
O 均为强酸。
均为强酸。所以答案应为C。
普通化学
